- HOME
- 取り組み
- 身の回りの金属を知ろう
- 金属が製品になるまで
金属は身近なところで活躍しています。
身の回りに溢れている金属製品について、知っているようで知らない事がたくさんあります。
どこでどんなふうに活躍しているか、身の回りの金属について知ってみませんか?
vol.1チタン眼鏡フレームの材料はどうやって作るの?
チタンの原料は 金属元素としては地球上でもっとも資源的に豊富に存在するシリコン、鉄に次いで、アルミニウムAlと争うチタンTiである。 しかし、最近は高品位ルチル鉱石が枯渇してきた。埋蔵量のきわめて大きな鉱石であるイルメナイトは、化学式ではFeTiO₃であり、金属Tiに対しては 不純物Feは機械的強度を低下させるので、不倶戴天の敵とされる。TiはFeと仲が悪いのである。さて、イルメナイトはFeをたっぷりと含有しているので、 Feを徹底的に除去するのがまずもって、Ti製造の要である。これを鉱山近くで大まかに除去して出発原料TiO₂に加工している。日本に輸入される金属チタン原料は主としてこのTiO₂である。

(TiO₂には結晶構造の違いによってアナターゼ型、ルチル型、ブルッカイト型の存在が知られている。白色塗料として多く途いられているのはルチル型である。)
酸化チタンの強い結合
TiO₂を出発原料として金属Tiを製造するためには、TiO₂から酸素を除去すれば良い(還元)。残念なことに、TiO₂の結晶の中でTiと酸素の化学結合はきわめて強く、 容易にその結合を切ることが出来ない。真空度に直すと10-100気圧という超高真空に保っても結晶から酸素をガスとして遊離させることが出来ない。このように酸化 物を加熱して酸素を手放すことが出来る金属は銀や水銀などに限られており、鉄やチタンの製造には工夫が必要である。
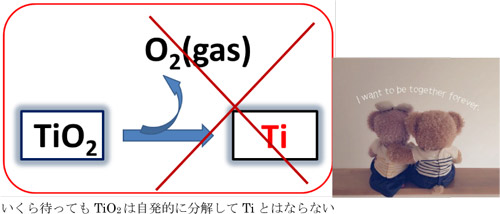
酸化チタンの直接還元は出来ない
たとえば、鉄鉱石中のFe₂O₃は炭素Cと反応して一酸化炭素COガスとなり酸素を手放すので、Cを犠牲にした「直接反応」でFeを得ることが出来る。これを酸化物の「直接還元」という。
Fe₂O₃ + C = Fe + CO(gas)
しかし、TiO₂中のTi-O結合はC-O結合よりも強固で有り、水素や炭素を作用させても低級酸化物のTi₂O₃やTiOを得ることは出来ても、金属Tiを得ることは出来ない。また過剰に投入したCはTiCを生成してTiとはならない。 不純物TiCは堅くてもろいので、強靱で延性のあるTiを作るにはC汚染は嫌われる。
直接還元の要件は
このように直接還元では
- 還元剤(相手の酸化物から酸素を引きはがす薬、Rとしよう)は、酸素に働きかけ、Tiと結合するよりもRと反応して化合物ROになりやすい性質が必要である。
- さらにRはTiと化合物を作ってはならないし、Tiに溶け込んでも困る。
- RはROとなるので通常、捨て去ることになり、Rは安価なものでなくてはならない。
このような3つの関門を経て良い還元剤Rを見つける必要がある。例えばCaは①と②の制約を満たすが、③を満足することが難しい。
間接還元とは
そこで、②の制限を緩め、一旦TiXという中間生成物を作っても良いことにする。図に示す間接還元である(図で反時計回りのプロセス)。一旦この物質XにTiO₂の酸素を渡してXをXOとする。 また過剰のXを与えてTiXと変えてしまう。その後、第二段階の別プロセスとして、TiXから今度はXを引きはがしてTiを得る方法である。一見、回り道で手間のようであるが、XにClを選ぶと直接還元よりも高品質な Tiが製造できるようになった。我が国では全面的に塩素を使う間接還元が1950年代から採用され、現在では中国、ロシア、アメリカ、の4カ国で製造されている。我が国は世界二位のTi生産国となっている。
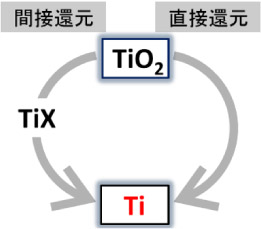
クロール法とは
Xに塩素Clを採用したのがWilliaum J. Kroll博士で、80年前の1936年にKrollの画期的な挑戦によりTiは工業的に大量生産できる道筋をつけた。現在クロール法と呼ばれるこの方法は、 いろいろの改良が加えられ、間接還元で有りながら効率の良い生産方法になってきた。クロール法のイメージを図2に示した。
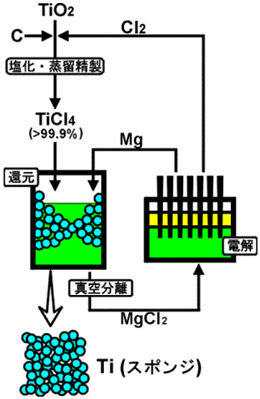
3つの工程からなるクロール法
①TiO₂にCl₂ガスを作用させても四塩化チタンTiCl₄は得られないが、Cを同時に作用させると、CがCOガスとなると共にTiCl₄が生成する。

②この工程の後、粗TiCl₄を蒸留分離によって純粋なTiCl₄のみと純度を上げた後、液体TiCl₄を液体Mgに滴下して作用させ、強い発熱を伴いつつ金属Tiを得る。 この還元工程では、Mgは塩素成分と化合して溶融MgCl₂となる。

③ この副産物MgCl₂は捨てずに別容器に取り出し、電気分解してMgとCl₂ガスに分解する。MgはTiCl₄の還元剤として、またCl₂ガスはTiO₂の塩素化剤として活用するので、工場から排出されるのはCOもしくはCO₂ガスのみとなる。
(MgCl₂電気分解のイメージ)、
このようにチタンの製造工程で現れるMg, Clは工場内でリサイクルされ、工場外に出ることはない。
クロール法で作成したスポンジチタンとは
製品のチタンは固体で、細かい粒子が焼結して珊瑚礁のような形態で有り、スポンジチタンと呼ばれる。 これはスポンジのように多孔質でかさ高な金属で、不純物のMgCl₂を多く含む。

大部分は反応終了後に液体MgCl₂として抜き取られるが、さらに加熱してMgCl₂ガスとして蒸発除去する。
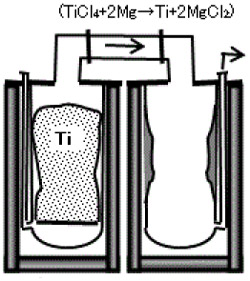
このあと、冷却するので、全工程ではおよそ数日を要するが、現在では一つの容器から約10トンの金属チタンが得られる。

金属チタンの製造はこのように回分式(バッチ式)に行われるので需要に対応しやすいが、熱管理上は不利で、連続化が望まれる。
スポンジチタンから金属塊へ
さて、得られたスポンジチタンは細かく裁断され、再びプレス成形してアルゴンガス中でアーク溶解に供される。 イオン化したアルゴンイオンが消耗式電極を少しずつ溶かしてチタン溶湯へ液滴を滴下させる。チタン溶湯は1500℃以上であるので水冷銅で連続冷却してチタンインゴット (鋳塊)を作成する。一旦冷却されたインゴットは圧延工場で再び加熱され、粗圧延、精密圧延などの工程を経てチタン板やチタンパイプなどに加工整形される。チタンは低温では六方晶であるため冷間加工性に乏しい。

加熱することによって、結晶中にたまった歪みを除去すると共に、体心立方構造のチタンに変態させると加工が容易になるので、圧延の途中で何度か焼鈍と呼ばれる加熱処理を施す。このとき、 チタンは大気中の酸素や窒素と反応しやすく、チタン板の表面酸化を防止するためアルゴンガス中での熱処理となる。

得られたチタン板は全国に数百社あるチタン金属加工業の会社に回り、各種金属チタン製品に加工される。
お奨め関係サイト
大阪チタニウムテクノロジーズ (OTC) 製品案内
http://www.osaka-ti.co.jp/product/titan/
動画で製造工程を詳しく説明している。
もっと金属について詳しく知りたい方はコチラから
関連サイト集

